( 关键词:滴定分析,酸碱滴定法,滴定曲线,指示剂,滴定突跃,滴定突跃范围 )
酸碱滴定法是以酸碱反应为基础的滴定分析方法。利用该方法可以测定一些具有酸碱性的物质,也可以用来测定某些能与酸碱作用的物质。有许多不具有酸碱性的物质,也可通过化学反应产生酸碱,并用酸碱滴定法测定它们的含量。因此,在生产和科研实践中,酸碱滴定法的应用相当广泛。
一、滴定曲线与指示剂的选择
(一)强碱滴定强酸
强碱滴定强酸时发生的反应为
上述反应的平衡常数为Kt为
现以0.1000mol·L-1NaOH溶液滴定20.00mL,0.1000mol·L-1HCL.溶为例,讨论滴定过程中溶液pH值的变化情况。
1.滴定前
溶液[H+]等于HCL的初始浓度:
[H+]=c(HCl)=0.100mol.L-1
pH=-lg[H+]=1.00
2.化学计量点前
溶液的[H+]决定于剩余HCL的浓度
例如,当滴入18.00mLNaOH溶液时,有90%的HCL被中和,剩余HCL物质的量为0.1000×20.00-0.1000×18.00=0.2000mmol,此时溶液的总体积为38.00mL,则溶液的[H+]为:
[H+]=0.2000/38.00=5.3*10-3(mol.L-1)
pH=-lg[H+]=-lg5.3*10-3=2.28
用类似的方法可求得当加入19.98mL NaOH时溶液的PH值为4.30。
3.化学计量点时
当加入20.00mLNaOH溶液时,HCL溶液被100%的中和,变成了中性的NaCL水溶液,故溶液的PH值由水的离解决定。
4.化学计量点后
溶液的PH值由过量的NaOH的量和溶液的总体积决定。即
例如,当加入20.02ml NaOH溶液时, NaOH溶液过量0.02ml,溶液的总体积为40.02ml,则溶液的[OH-]为:
pOH=4.30
pH=14.00-4.30=9.70
根据上述方法可以计算出不同滴定点时溶液的PH值,部分结果列于表7-1。根据表中的数据作图,即可得到强碱滴定强酸的滴定曲线图7-1中的a。 医学 全在.线提供www.med126.com
图7-1 NaOH与HCL的滴定曲线
c(NaOH)=c(HCl) =0.1000mol.L-1
图7-1
表7-1 用NaOH滴定HCL时溶液PH的变化(c(NaOh )=c(HCL)=0.1000mol·L-1)
|
V(加入NaOH)
ml |
被滴定HCL的百分含量% |
V(剩余HCL)
ml |
V(过量NaOH)ml |
[H3O+]
mol·L-1 |
PH |
|
0 |
0 |
20.00 |
|
1.00×10-1 |
1.00 |
|
19.00 |
90.00 |
2.00 |
|
5.26×10-3 |
2.28 |
|
19.80 |
99.00 |
0.20 |
|
5.02×10-4 |
3.30 |
|
19.98 |
99.90 |
0.02 |
|
5.00×10-5 |
4.30 |
|
20.00 |
100.00 |
0.00 |
|
1.00×10-7 |
7.00 |
|
20.02 |
100.1 |
|
0.02 |
2.00×10-10 |
9.70 |
|
20.20 |
101.0 |
|
0.20 |
2.01×10-11 |
10.70 |
滴定曲线不仅说明了滴定时溶液PH值的变化方向,而且也说明了各个阶段的变化速度。从图中可以看出,曲线自左至右明显分成三段。前段和后段比较平坦。溶液的PH值变化缓慢,中段曲线近乎垂直。在化学计量点附近PH值有一个突变过程。这种PH值突变称之为滴定突跃,突跃所在的PH值范围称为滴定突跃范围(常用化学计量点前后各0.1%的PH范围表示,本例的突跃范围是(4.30-9.70)。
最理想的指示剂应该能恰好在反应的化学计量点发生颜色变化,但在实际工作中很难使指示剂的变色范点和化学计量点完全统一。因此,指示剂的选择主要以滴定的突跃范围为依据,通常选取变色范围全部或部分处在突跃范围内的指示剂滴定终点,这样产生的疑点误差不会超过±0.1%。在上述滴定中,甲基橙(PH3.1-4.4)和酚酞(PH8.0-10.0)的变色范围均有一部分在滴定的突跃范围内,所以都可以用来指示这一滴定疑点此外,甲基红、溴酚蓝和溴百里酚蓝等也可用作这类滴定的指示剂。
滴定突跃的大小与溶液的浓度密切相关。若酸碱浓度均增大10倍,滴定突跃范围将加宽2个PH单位;反之,若酸碱浓度减小10倍,相应的突跃范围将减小2个PH单位。可见浓度愈高突跃范围越大,浓度越低突跃范围越小,如果滴定时所用的酸碱浓度相等并小于2×10-4mol ·L-1,滴定突跃范围就会小于0.4个PH单位,用一般的指示剂就不能准确地指示出终点。故将c≥2×10-4mol ·L-1作为此类滴定能够准确进行的条件。
强酸滴定强碱的滴定曲线如图7-1中的曲线b所示。指示剂的选择及滴定反应用及其滴定条件等与前述滴定相似。
青果园电厂化学资料网面向电厂化学专业人士为主提供网络信息服务,是一个公益性非赢利性的网站,无论是驻站作者原创的作品,还是由读者投稿或转载的文章,其版权均归原作者所有,所有使用必须事先征得原作者同意,若作者有版权声明的或文章从其他网站转载而附带有原所有站的版权声明者,其版权归属以附带声明为准。




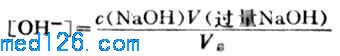


 最新评论
最新评论